| Safinamide | |
|---|---|
 | |
| Nome IUPAC | |
| N2-{4-[(3-fluorobenzyl)oxy]benzyl}-L-alaninamide | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C17H19FN2O2 |
| Numero CAS | |
| Numero EINECS | 603-772-2 |
| PubChem | 131682 |
| DrugBank | DBDB06654 |
| SMILES | CC(C(=O)N)NCC1=CC=C(C=C1)OCC2=CC(=CC=C2)F |
| Dati farmacocinetici | |
| Metabolismo | Amidasi, glucuronidazione |
| Emivita | 20–30 ore |
| Escrezione | 76% Rene, 1.5% Feci |
| Indicazioni di sicurezza | |
La safinamide ( DCI; marchio Xadago ) è un farmaco usato come trattamento aggiuntivo per il morbo di Parkinson con episodi off; ha molteplici modalità d'azione, inclusa l'inibizione della monoamino ossidasi B.[1][2][3]
È stato approvato nell'Unione Europea nel febbraio 2015,[4] negli Stati Uniti nel marzo 2017,[5] e in Canada nel gennaio 2019.[6]
Usi medici
La safinamide è usata per il trattamento della malattia di Parkinson idiopatica come terapia adiuvante per le persone che assumono una dose stabile di levodopa (L-dopa) da sola o in combinazione con altri farmaci per il Parkinson, per aiutare con gli episodi off quando la levodopa smette di funzionare.[4][7][8]
Controindicazioni
La safinamide è controindicata nelle persone con grave insufficienza epatica, o affette da albinismo, retinite pigmentosa, grave neuropatia diabetica, uveite e altri disturbi della retina . Anche la combinazione con altri inibitori delle monoaminossidasi (MAO) e petidina è controindicata.[4]
L'assunzione non è indicata per le donne in gravidanza.[7] Il farmaco viene escreto nel latte materno e gli effetti sui neonati non sono noti.[4]
Effetti collaterali
Gli eventi avversi comuni negli studi clinici (in oltre l'1% delle persone) includevano nausea, vertigini, stanchezza, insonnia, ipotensione ortostatica (bassa pressione sanguigna) e mal di testa. Non vi è stata alcuna differenza significativa nell'occorrenza di questi effetti tra safinamide e placebo.[9][10]
Negli esperimenti con i ratti (ma non in quelli con le scimmie) sono state osservate retinopatie.[11]
Overdose
Gli effetti da sovradosaggio attesi sono ipertensione (pressione sanguigna alta), ipotensione ortostatica, allucinazioni, agitazione psicomotoria, nausea, vomito e discinesia. Negli studi, si sospettava che una sola persona avesse un'overdose per un mese; i sintomi erano confusione, sonnolenza e midriasi (dilatazione delle pupille) e si attenuavano completamente dopo la sospensione del farmaco. Non è disponibile alcun antidoto specifico.[12]
Interazioni
In quanto inibitore delle MAO, la safinamide può teoricamente causare crisi ipertensive, sindrome serotoninergica e altri gravi effetti collaterali se combinata con altri inibitori delle MAO o con farmaci noti per interagire con gli inibitori delle MAO, come petidina, destrometorfano, inibitori selettivi della ricaptazione della serotonina (SSRI), inibitori della ricaptazione della serotonina-noradrenalina (SNRI), antidepressivi triciclici e tetraciclici . Secondo la stessa logica, gli studiosi si aspettavano di osservare un'interazione con la tiramina, una sostanza presente in vari alimenti, ma negli studi è stata esclusa.[12]
La safinamide non deve essere somministrata con gli oppioidi; si sono verificate alcune reazioni fatali.[7]
Un'altra interazione teorica è con farmaci affini alla proteina trasportatrice ABCG2 (nota anche come BCRP), come pitavastatina, pravastatina, ciprofloxacina, metotrexato e diclofenac; uno studio con quest'ultimo non ha mostrato rilevanza clinica.[13] Uno studio che testa le possibili interazioni con gli inibitori dell'amidasi fa parte del piano di sviluppo post-autorizzazione. Non ci sono interazioni rilevanti correlate agli enzimi epatici del citocromo P450 (CYP), sebbene una via di inattivazione della safinamide sembri essere mediata dal CYP3A4 .[12]
Farmacologia
Meccanismi d'azione
Come i vecchi farmaci antiparkinson selegilina e rasagilina, la safinamide è un inibitore selettivo della monoammino ossidasi B, che riduce la degradazione della dopamina; a differenza degli altri due, la sua azione è reversibile. La safinamide inibisce anche il rilascio di glutammato[14][15] e la ricaptazione della dopamina e della serotonina.[16] Si lega anche ai recettori sigma, con valori di IC 50 per l'inibizione del legame di 19 nM per σ 1 e 1.590 nM per σ .[17] Inoltre, blocca i canali del sodio del calcio,[18] la cui rilevanza per la sua azione antiparkinson è tuttavia sconosciuta.[12]
Farmacocinetica
La safinamide viene assorbita rapidamente e quasi completamente dall'intestino e raggiunge le concentrazioni plasmatiche più elevate dopo 1,8-2,8 ore. Non esiste un metabolismo di primo passaggio rilevante; la biodisponibilità totale è del 95%. La sostanza è legata alle proteine plasmatiche per l'88–90%.[12]
Il metabolismo non è ben compreso. Il passaggio principale è mediato da amidasi che non sono state identificate e produce acido safinamidico (NW-1153). Altri metaboliti rilevanti sono la safinamide O-debenzilata (NW-1199),[19] l'ammina N-dealchilata che viene poi ossidata ad acido carbossilico (NW-1689) e il glucuronide di quest'ultimo.[12][20] Nei test con microsomi epatici, la dealchilazione sembrava essere mediata dal CYP3A4, ma sembrano essere coinvolti anche altri enzimi CYP. L'acido safinamidico si lega al trasportatore di anioni organici 3 (OAT3), ma questo probabilmente non ha rilevanza clinica. La stessa safinamide si lega transitoriamente all'ABCG2. Negli studi preliminari non sono state trovate altre affinità di trasportatore.
La safinamide viene eliminata, principalmente (>90%) sotto forma dei suoi metaboliti, per via renale, con un'emivita di eliminazione compresa tra 20 e 30 ore. Solo l'1,5% si trova nelle feci.[12]
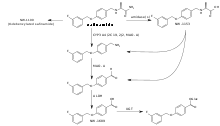
Storia
Il composto è stato originariamente scoperto presso Farmitalia-Carlo Erba,[22] che è stata acquisita da Pharmacia nel 1993. Nel 1995, Pharmacia si è fusa con Upjohn. La safinamide è stata resa nota per la prima volta nel 1998.[23] Nel corso di un'importante ristrutturazione aziendale nello stesso anno, tutti i diritti per la safinamide sono stati trasferiti alla nuova società Newron Pharmaceuticals, che ha sviluppato il farmaco fino a quando non è stato venduto a Merck KGaA nel 2006.[24]
Nel 2007 è stata avviata una sperimentazione clinica di Fase III, prevista fino al 2011.[25] Nell'ottobre 2011 Merck, ora Merck-Serono, ha annunciato che avrebbe restituito tutti i diritti per lo sviluppo del composto a Newron perché voleva dare la priorità ad altri progetti e aveva corretto le proprie stime per il potenziale di mercato della safinamide al ribasso.[26]
La Food and Drug Administration (FDA) statunitense ha rifiutato di la domanda di registrazione presentata da Newron nel 2014 per motivi formali.[27] Newron ha presentato nuovamente domanda nel dicembre dello stesso anno.[28] Nella primavera del 2015, a seguito di un accordo commerciale tra Newron e l'azienda farmaceutica italiana Zambon, l'Agenzia Europea dei Medicinali (EMA) ha approvato il farmaco[29]. Negli anni successivi il farmaco è stato lanciato in diversi paesi europei[30]. La safinamide è stato il primo farmaco antiparkinson approvato in circa dieci anni.[31] La safinamide è stata approvata dalla FDA statunitense nel marzo 2017 per le persone con Parkinson che assumevano levodopa/carbidopa durante gli episodi off.[32][33]
Ricerca
Potenziali usi aggiuntivi potrebbero essere la sindrome delle gambe senza riposo (RLS) e l'epilessia.[34] La safinamide è stata testata in studi di Fase II nel 2008, ma non sono disponibili risultati. Quando usata in aggiunta ai farmaci antiparkinson, la safinamide si è rivelata efficace nel ridurre il dolore nel morbo di Parkinson.[35]
Note
- ↑ (EN) medicines.org.uk, http://www.medicines.org.uk/emc/medicine/31917. URL consultato il 2 aprile 2017.
- ↑ accessdata.fda.gov, https://www.accessdata.fda.gov/drugsatfda_docs/label/2017/207145lbl.pdf. URL consultato il 2 aprile 2017.
- ↑ The safety and efficacy of safinamide mesylate for the treatment of Parkinson's disease., vol. 16, 2016, DOI:10.1586/14737175.2016.1150783, PMID 26849427.
- 1 2 3 4 (EN) medicines.org.uk, http://www.medicines.org.uk/emc/medicine/31917. URL consultato il 2 aprile 2017."Xadago - Summary of Product Characteristics".
- ↑ accessdata.fda.gov, https://www.accessdata.fda.gov/drugsatfda_docs/label/2017/207145lbl.pdf. URL consultato il 2 aprile 2017."Safinimide label" (PDF).
- ↑ Health Canada, https://health-products.canada.ca/dpd-bdpp/info.do?lang=en&code=97495. URL consultato il 21 luglio 2019.
- 1 2 3 accessdata.fda.gov, https://www.accessdata.fda.gov/drugsatfda_docs/label/2017/207145lbl.pdf. URL consultato il 2 aprile 2017."Safinimide label" (PDF).
- ↑ The safety and efficacy of safinamide mesylate for the treatment of Parkinson's disease., vol. 16, 2016, DOI:10.1586/14737175.2016.1150783, PMID 26849427.Perez-Lloret, S; Rascol, O (2016).
- ↑ (DE) 2015.
- ↑ (DE) H. Spreitzer.
- ↑ (DE) Klement, A, Xadago, 18 luglio 2016.
- 1 2 3 4 5 6 7 (DE) 2015. Haberfeld, H, ed. (2015).
- ↑ ema.europa.eu, http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Product_Information/human/002396/WC500184965.pdf.
- ↑ (DE) H. Spreitzer, Neue Wirkstoffe – Safinamid, 14 aprile 2014.H. Spreitzer (14 April 2014).
- ↑ Safinamide: From molecular targets to a new anti-Parkinson drug, vol. 67, 2006, DOI:10.1212/wnl.67.7_suppl_2.s18, PMID 17030736.
- ↑ Clinical pharmacology review of safinamide for the treatment of Parkinson's disease, vol. 5, 2015, DOI:10.2217/nmt.15.46, PMID 26587996.
- ↑ Biochemical and electrophysiological studies on the mechanism of action of PNU-151774E, a novel antiepileptic compound, vol. 288, 1999, PMID 10027853.
- ↑ Sodium channel activity and sigma binding of 2-aminopropanamide anticonvulsants, vol. 9, 1999, DOI:10.1016/s0960-894x(99)00415-1, PMID 10498200.
- 1 2 ema.europa.eu, http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Product_Information/human/002396/WC500184965.pdf."Summary of Product Characteristics for Xadago" (PDF).
- ↑ Effects of ketoconazole treatment on the pharmacokinetics of safinamide and its plasma metabolites in healthy adult subjects, vol. 33, 2012, DOI:10.1002/bdd.1822, PMID 23097240.
- ↑ Effects of ketoconazole treatment on the pharmacokinetics of safinamide and its plasma metabolites in healthy adult subjects, vol. 33, 2012, DOI:10.1002/bdd.1822, PMID 23097240.Krösser, Sonja; Marquet, Anne; Gallemann, Dieter; Wolna, Peter; Fauchoux, Nicolas; Hermann, Robert; Johne, Andreas (2012).
- ↑ Discovery and Development of Safinamide, a New Drug for the Treatment of Parkinson's Disease, vol. 3, 2018, DOI:10.1002/9783527808694.ch14, ISBN 9783527808694.
- ↑ Synthesis and Anticonvulsant Activity of a New Class of 2-[(Arylalkyl)amino]alkanamide Derivatives, vol. 41, 1998, DOI:10.1021/jm970599m, PMID 9484507.
- ↑ (DE) http://www.merck.de/de/presse/extNewsDetail.html?newsId=81B6B9E2441C1015C12577D0007DBBCC&newsType=1.
- ↑ Study of Safinamide in Early Parkinson's Disease as Add-on to Dopamine Agonist (MOTION)
- ↑ Merck Returns Rights for Safinamide to Newron, 21 October 2011.
- ↑ Copia archiviata. URL consultato il 10 agosto 2022 (archiviato dall'url originale il 4 marzo 2016).
- ↑ Copia archiviata (PDF). URL consultato il 10 agosto 2022 (archiviato dall'url originale il 4 marzo 2016).
- ↑ Xadago EPAR Public assessment report
- ↑ Parkinson, Zambon annuncia l’arrivo in Italia di safinamide.
- ↑ (DE) Klement, A. Klement, A (18 July 2016).
- ↑ (EN) fda.gov, https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm547852.htm.
- ↑ (EN) endpts.com, https://endpts.com/after-an-odyssey-of-setbacks-fda-finally-green-lights-newrons-parkinsons-drug-xadago/. URL consultato il 21 marzo 2017.
- ↑ Drug evaluation: Safinamide for the treatment of Parkinson's disease, epilepsy and restless legs syndrome, vol. 8, 2007, PMID 17659477.
- ↑ Comprehensive Examination of Therapies for Pain in Parkinson's Disease: A Systematic Review and Meta-Analysis, vol. 51, 2018, DOI:10.1159/000492221, ISSN 1423-0208, PMID 30153669.
Altri progetti
 Wikimedia Commons contiene immagini o altri file su Safinamide
Wikimedia Commons contiene immagini o altri file su Safinamide
Collegamenti esterni
- druginfo.nlm.nih.gov, https://druginfo.nlm.nih.gov/drugportal/name/safinamide.
- druginfo.nlm.nih.gov, https://druginfo.nlm.nih.gov/drugportal/name/safinamide%20mesylate.